Tarea de química
Tema:
Enlaces químicos
Docente:
Lic. Emiliano Murillo M.
Sección:
11-1
Estudiantes:
Andrea Brenes Avila
Yariela Navarro Abarca
Cartago, Costa Rica-2022
Clasificación del enlace químico:
Enlace Iónico:
Este enlace consiste en la atracción de átomos con cargas eléctricas de signos diferentes, es decir, el enlace se establece con átomos de elementos poco electronegativos se enlazan con átomos de elementos muy electronegativos, lo cual sucede con elementos de los extremos izquierdos de la tabla periódica que son metales con el lado derecho que pertenecen a los no metales.
El elemento menos electronegativo que corresponde a los metales cede sus electrones a los elementos más electronegativos que son los no metales.
El enlace iónico se efectúa por transferencia de electrones del metal que tiene menos electrones al no metal que tiene más electrones.
Ejemplo:
Del lado izquierdo, se muestra la representación del símbolo de Lewis para cada elemento que interviene en el enlace, del lado derecho, la estructura resultante de Lewis cuando los metales han transferido o cedido sus electrones de valencia, convirtiéndose en catión para que los no metales completen 8 electrones en su último nivel transformándose en anión.
Diferencia de electronegatividad
La electronegatividad, de acuerdo a Linus Pauling, es una propiedad periódica que indica la tendencia de un átomo para atraer hacia sí a los electrones. La escala de Pauling asigna valores a cada elemento que representa el poder de atracción de los electrones en un enlace químico y por medio de esos valores puede ser establecido el carácter iónico o covalente de un enlace.
El elemento menos electronegativo es el francio (Fr) con un valor de 0.7
El más electronegativo es el flúor (F) con un valor de 4.0
La siguiente tabla periódica muestra los valores de la escala de Pauling.
Las sustancias formadas por enlaces iónicos poseen las siguientes propiedades:

Las siguientes imágenes muestran algunas propiedades como son el estado de agregación sólido, la propiedad de conducir la corriente eléctrica cuando se encuentra en solución acuosa, la fusión de un sólido, la ebullición de un líquido, la formación de soluciones acuosas a partir de un solvente polar como es el agua.
Cloruro de sodio (sólido) | En solución acuosa conducen calor y electricidad |
 Punto de fusión: 801 °C Punto de ebullición: 1413 °C |  |


El enlace covalente
Enlace covalente polar:
En la siguiente imagen se representa el enlace entre los no metales (hidrógeno y oxígeno) y la característica de su diferencia de electronegatividad con un resultado de 1.4, menor a 1.7 y mayor a 0.4.

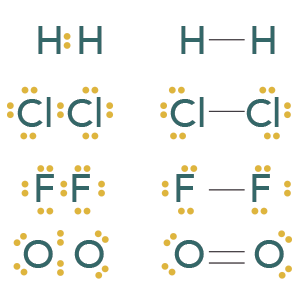
Enlace covalente no polar o puro
Se efectúa entre no metales cuando se enlazan dos átomos iguales con el mismo valor de electronegatividad, la diferencia es cero. O bien, no metales distintos, pero con una diferencia de electronegatividad de 0.4. El enlace formado se llama covalente no polar o puro ya que los electrones son atraídos de la misma forma por ambos átomos. Los átomos que participan completan su octeto.
Enlace covalente coordinado o dativo
El enlace se efectúa entre no metales en donde uno de los átomos del elemento no metálico aporta un par de electrones a otro no metal y ambos completan su octeto.
Se representa con una flecha dirigida del átomo que aporta hacia el que recibe.
Por ejemplo, para el ácido sulfúrico (H2SO4):

En el caso del ácido sulfúrico el azufre forma dos covalentes coordinados con dos átomos de oxígeno, y con los otros dos oxígenos que están unidos a su vez a los hidrógenos forma covalentes polares.
Para el dióxido de azufre (SO2):
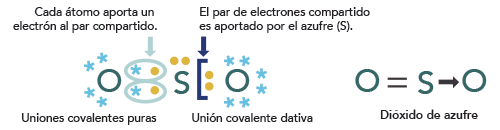
En este compuesto (dióxido de azufre -SO2-) el azufre forma un enlace covalente polar doble con uno de los átomos de oxígeno y con el otro átomo de oxígeno el azufre aporta un par de electrones para que el oxígeno también complete su octeto al igual que el azufre.
La condición para que exista este tipo de enlace es que los átomos que participan sean no metales.
Simple, doble y triple covalencia
Los enlaces covalentes pueden ser de simple, doble o triple covalencia entre átomos, esto sucede cuando comparten un electrón, dos electrones o hasta tres para así completar cada átomo que participa en la covalencia de su respectivo octeto.
Por ejemplo, en la molécula de hidrógeno (H2) basta con que cada átomo comparta su electrón y forme una covalencia simple; tener dos electrones para el hidrógeno lo hace estable.
Para que cada uno de los dos átomos de oxígeno (O2) en una molécula complete un octeto de electrones es necesario que compartan entre ellos dos pares electrónicos. A esta situación se le conoce como doble enlace.
De manera análoga, la formación de la molécula diatómica de nitrógeno (N2) mediante el modelo de Lewis lleva a plantear un triple enlace entre los átomos de nitrógeno (N) para que ambos completen el octeto.

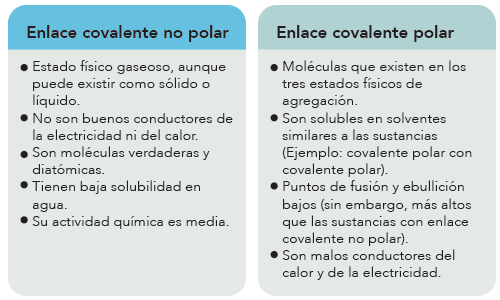
Las propiedades de las sustancias con enlace covalente, polar y no polar, son:
Enlace metálico
Los átomos de los metales (en estado sólido) se encuentran unidos por medio del enlace metálico. Todos y cada uno de los átomos del metal comparten los electrones del último nivel de energía, forman así una red tridimensional y compacta de cationes ordenados llamada cristal metálico que está inmersa en una nube de electrones compartidos; esta estructura tiene gran estabilidad.
Ya que los átomos de los metales tienen pocos electrones en su última capa, por lo general 1, 2 ó 3, éstos pierden fácilmente esos electrones (electrones de valencia) y se convierten en iones positivos, por ejemplo: Na+, Cu2+, Mg2+. Los iones positivos resultantes se ordenan en el espacio y forman la red metálica.
Los electrones de valencia desprendidos de los átomos forman una nube de electrones que puede desplazarse a través de toda la red. De este modo, todo el conjunto de los iones positivos del metal queda unido mediante la nube de electrones con carga negativa que los envuelve.
Aplicaciones del enlace metálico
Las aplicaciones de sustancias derivadas del enlace metálico son variadas, por ejemplo, se encuentran en las aleaciones que se emplean en materiales para la industria automotriz (equipo, material del que se fabrican los autos), en la medicina (equipo, instrumental, dispositivos, curaciones) y en la industria metal mecánica (maquinaria, aeronáutica, herramientas, etc.).
En general, los metales no se utilizan en estado puro sino que se realizan aleaciones con el objeto de mejorar o variar sus propiedades originales.
La aleación se define como la mezcla de dos o más metales o de metales con no metales, de tal forma que la mezcla resultante presenta características metálicas diferentes a las propiedades del metal que le dan origen; comúnmente estas propiedades son mejoradas o potenciadas.
La mayor parte de las aleaciones metálicas se forman en estado líquido.
Tema Video













Comentarios
Publicar un comentario